Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 15.4. Тепловой эффект реакции
Дальше: 15.6. Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе
15.5. Масса (объем, количество вещества) продукта по реагенту в избытке или с примесями
Избыток и недостаток реагентов. Количества, массы и объемы (для газов) реагентов не всегда берутся стехиометрическими, т. е. в соответствии с уравнениями реакции. Чаще один из реагентов берется в избытке, а следовательно, другой реагент оказывается в недостатке. Избыток реагента участвовать в реакции не будет.
Для реакции aA + bB = cC + dD определение реагентов, взятых в избыткеи в недостатке, проводят по неравенству (А – в недостатке, В – в избытке):
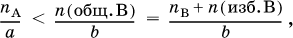
где n(общ. В) – общее (взятое с избытком) количество реагента В, пB – стехиометрическое (необходимое для реакции) количество В, n(изб. В) – избыточное количество В, причем
n(изб. B) = n(общ. B) – nB.
Внимание! Расчет получаемых количеств (масс, объемов) продуктов проводят по реагенту в недостатке.
Степень чистоты вещества. Химические вещества никогда не бывают идеально чистыми, они всегда содержат в себе примеси.
Массовая доля вещества В в смеси, например А + В + С, – это отношение массы вещества В к массе смеси:
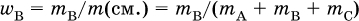
Сумма массовых долей всех веществ смеси равна 1 (100 %).
Если в смеси примесь присутствует в следовом (неопределяемом) количестве, то говорят о практически чистом веществе. Когда же в веществе имеется примесь в заметном (определяемом) количестве, то само вещество называют основным (его количество преобладает), а другое вещество – это и есть примесь.
Степень чистоты основного вещества В – это массовая доля этого вещества в навеске с определенной массой:
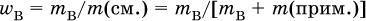
Природные вещества (минералы, руды) всегда содержат заметное количество примеси (примесей).
Пример решения задачи
Углекислый газ поглощается 10 %-ным раствором аммиака (плотность раствора 957 г/л) с образованием кислой соли. Предварительно СO2 получают термическим разложением 5 кг известняка СаСO3 (степень чистоты 60 %). Установите взятый объем (в литрах) раствора аммиака. Элементы ответа.
1) Составлены уравнения реакций:
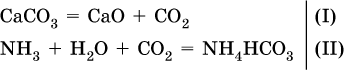
2) Установлено количество основного вещества в известняке:
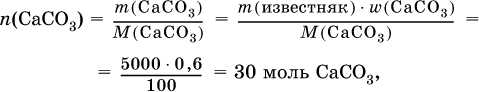
и количество углекислого газа по уравнению (I):
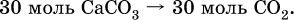
3) Установлена масса затраченного аммиака по уравнению (II):
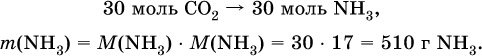
4) Установлен объем взятого раствора аммиака:
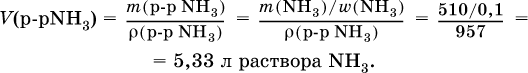
Задания для самостоятельного решения частей В, С
1. К 100 г 10 %-ного раствора хлорида кальция добавили 100 г 10 % – ного раствора AgNO3. Найдите массу (в граммах) осадка.
2. Смешали горячие растворы, содержащие по 33 г хлорида алюминия и сульфида калия. Установите объем (в литрах, н.у.) выделившегося газа.
3. Какой объем (в литрах, н.у.) хлора можно получить при взаимодействии 2 моль хлороводорода (взят в виде соляной кислоты) и 3 моль оксида марганца(IV)?
4. Через раствор, приготовленный из 2 г смеси NaCl + Nal и 100 мл воды, пропустили 1 л (н.у.) хлора. Затем раствор выпарили и сухой остаток нагрели. Получили 1,78 г твердого вещества. Рассчитайте массовую долю (в %) хлорида в исходном растворе.
5. Вычислите объем (в литрах, н.у.) газа, полученного действием кипящей H2SO4 (конц.) на 292,5 г хлорида натрия, содержащего 2O% инертных примесей.
6. После прокаливания 50 г минерала тенорит (CuО и инертные примеси) в токе водорода образуется металл и конденсируется вода объемом 8,1 мл. Определите степень чистоты (в %) этого минерала.
7. Установите массу (кг) технического алюминия (степень чистоты 98 %), требуемую для получения 64,22 кг хрома из оксида хрома (III).
8. Прокалили 32,1 г хлорида аммония с 55,5 г гидроксида кальция (содержит 20 % инертных примесей). Рассчитайте объем (в литрах, н.у.) собранного газа.
9. К 285 г нитрата натрия (содержит примесь хлорида магния) добавили раствор избытка нитрата серебра (I). Выпал осадок массой 86,1 г. Вычислите степень чистоты (в %) нитрата натрия.
10. Найдите массовую долю (в %) примеси NaHCO3 в образце технической соды Na2CO3, если после нагревания 10 г образца получено 9,69 г твердого остатка.
11. Смешали 20 г уксусной кислоты и 8,4 г питьевой соды NaHCO3. Определите объем (в литрах, н.у.) газа, собранного после окончания реакции.
12. На гидрирование 250 г смеси Cl7Н33СООН + Cl7Н35СООН затратили 16,8 л (н.у.) газа. Установите массовую долю (в %) предельной карбоновой кислоты в исходной смеси.
Назад: 15.4. Тепловой эффект реакции
Дальше: 15.6. Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе

