Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 14.3. Ряд напряжений металлов
Дальше: 15. Решение расчетных задач
14.4. Электролиз расплава и раствора
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов.
На отрицательно заряженном электроде — катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде — аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).
Примеры электролиза расплавов:
а)
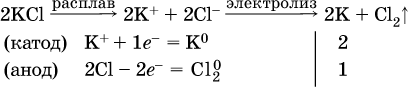
б)
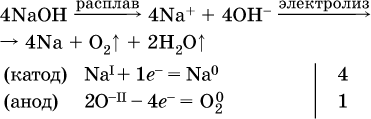
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита – воды):
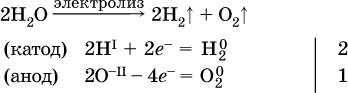
В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде (например, в присутствии K2SO4, H2SO4 или КОН).
При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например, Li+, К+, Са2+, Na+, Mg2+, Al3+), и никогда не окисляется на аноде кислород О-II анионов оксокислот с элементом в высшей степени окисления (например, ClO4-, SO42-, NO3-, РО43-, CO32-); вместо них окисляется вода.
Примеры электролиза растворов солей:
а)
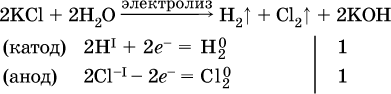
(на аноде окисляются анионы Cl-, а не кислород О-II молекул Н2O, так как электроотрицательность хлора меньше, чем у кислорода, и следовательно, хлор отдает электроны легче, чем кислород);
б)
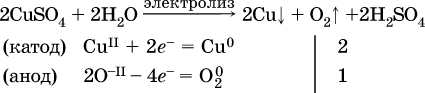
(на катоде восстанавливаются катионы Cu2+, а не водород НI молекул Н2O, так как медь стоит правее водорода в ряду напряжений, т. е. легче принимает электроны, чем НI в воде; подробнее см. 5.3).
Подчеркнем еще раз, что электролиз – это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут.
Примеры заданий частей А, В, С
1. В уравнении реакции
CuS + HNO3 (конц.) → CuSO4 + NO2↑ +… коэффициент у формулы окислителя равен
1) 1
2) 4
3) 8
4) 11
2. В уравнении реакции
К2Cr2O7 + НCl → CrCl3 + Cl2↑ +… коэффициент у формулы восстановителя – это
1) 14
2) 10
3) 6
4) 2
3―4. В уравнении реакции
3. Al + V2O5 → Al2O3 + V
4. MgC2 + Cl2 → MgCl2 + СCl4
сумма коэффициентов равна
1) 8
2) 13
3) 18
4) 24
5—6. В уравнении реакции
5. КMnО4 + Н2O + K2SO4 → MnO2↓ + K2SO4 + KOH
6. KI + H2O + Cl2 → KIO3 + HCl
сумма коэффициентов равна
1) 9
2) 10
3) 13
4) 14
7. Укажите соответствие между веществом (формула подчеркнута) и его функцией в реакции.
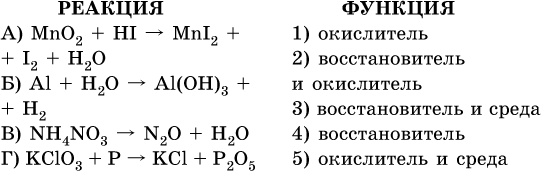
8. При электролизе расплава смеси гидроксида и хлорида калия набор продуктов на электродах – это
1) Н2, O2
2) К, O2
3) K, Cl2
4) Н2, Cl2
9. При электролизе раствора нитрата ртути (II) набор продуктов на электродах – это
1) Hg, O2
2) H2, O2
3) Hg, N2
4) H2, N2
10. Установите соответствие между веществом и продуктом, образующимся на катоде при электролизе раствора

11. Установите соответствие между веществом и продуктом, образующимся на аноде при электролизе раствора

12—14. Используя метод электронного баланса, составьте уравнение реакции по указанной схеме. Определите окислитель и восстановитель.
12. Mn(NO3)2 + HNO3 + РЬO2 → HMnO4 + Pb(NO3)2 +…
13. Zn + H2SO4 + HNO3 (разб.) → ZnSO4 + NO +…
14. K2Cr2O7 + HCl + C2H5OH → CrCl3 + CH3C(H)O +…
Назад: 14.3. Ряд напряжений металлов
Дальше: 15. Решение расчетных задач

