Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 14.1. Окислители и восстановители
Дальше: 14.3. Ряд напряжений металлов
14.2. Подбор коэффициентов методом электронного баланса
Метод состоит из нескольких этапов.
1. Записывают схему реакции; находят элементы, повышающие и понижающие свои степени окисления, и выписывают их отдельно:
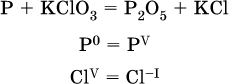
2. Составляют уравнения полуреакций окисления и восстановления:
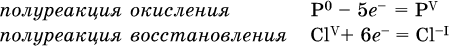
3. Подбирают дополнительные множители (справа за чертой) для уравнений полуреакций так, чтобы число электронов, отданных восстановителем, стало равным числу электронов, принятых окислителем:
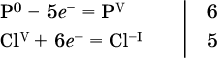
4. Проставляют найденные множители в качестве коэффициентов в схему реакции:
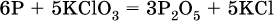
5. Проводят проверку по элементу, который не менял свою степень окисления (чаще всего – кислород):
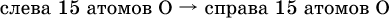
Примеры:
а)
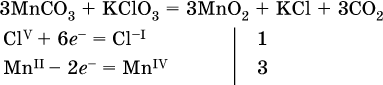
(коэффициент перед СO2 подбирается поэлементно и в последнюю очередь, проверка – по кислороду);
б)
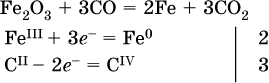
в)
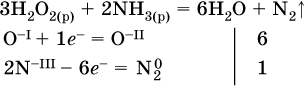
(простые вещества – здесь N2 – пишут в уравнениях полуреакций в молекулярном виде);
г)
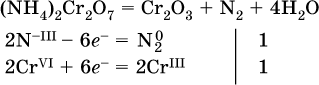
(реакция внутримолекулярного окисления-восстановления, расчет ведут на число атомов в формульной единице реагента – 2N-IIIи 2CrVI);
д)
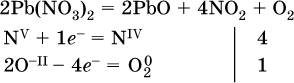
e)
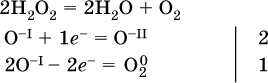
(реакция дисмутации, коэффициенты ставят сначала в правую часть уравнения);
ж)
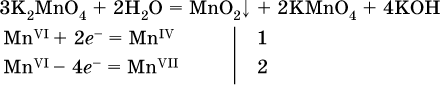
(коэффициент перед К2MnO4 находят суммированием числа атомов MnVI в правой части обоих уравнений полуреакций);
з)
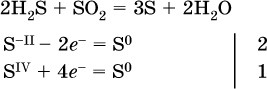
(реакция конмутации, коэффициенты ставят сначала в левую часть уравнения);
и)
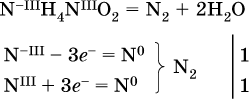
к)
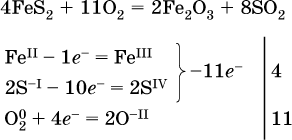
(в FeS2 окисляются атомы FeII FeIII и S-I → SIV, расчет ведут на число этих атомов в формульной единице реагента и суммируют число отданных электронов);
л)
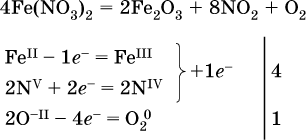
(в реагенте одновременно окисляются атомы первого слева и восстанавливаются атомы второго слева элементов: FeII → FeIII и NV → NIV, расчет ведут на число этих атомов в формуле реагента и алгебраически суммируют число электронов);
м)
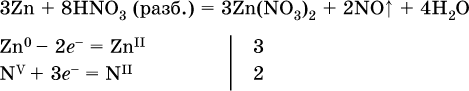
(коэффициент для HNO3 находят суммированием числа атомов N в правой части уравнения);
н)
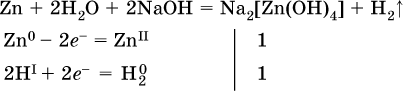
(в растворе Zn – восстановитель, H2O – окислитель; в молекуле воды восстанавливается один атом водорода из двух: НIОН – Н0);

(в расплаве восстанавливается атом водорода из гидроксид-иона [ОНI]- → Н0).
Назад: 14.1. Окислители и восстановители
Дальше: 14.3. Ряд напряжений металлов

