Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 13.2. Электролитическая диссоциация
Дальше: 13.4. Реакции ионного обмена
13.3. Диссоциация воды. Среда растворов
Сама вода – это очень слабый электролит:
Концентрации катиона Н+ и аниона ОН- в чистой воде весьма малы и составляют 1 10-7 моль/л при 25 °C.
Катион водорода Н+ представляет собой простейшее ядро – протон р+ (электронная оболочка катиона Н+ – пустая, 1s0). У свободного протона велики подвижность и проникающая способность, в окружении полярных молекул Н2O он не может оставаться свободным. Протон тут же присоединяется к молекуле воды:
В дальнейшем для простоты оставляется запись Н+ (но подразумевается Н3O+).
В воде содержание ионов Н+ и ОН одинаково; в водных растворах кислот появляется избыток ионов Н+, в водных растворах щелочей – избыток ионов ОН (за счет диссоциации кислот и оснований).
Типы среды водных растворов:
Содержание Н+ и ОН- в водных растворах обычно выражают через водородный показатель рН (читается пэ-аш) и аналогичный ему гидроксильный показатель рОН:
Для воды при комнатной температуре имеем:
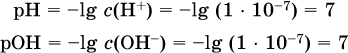
следовательно, в чистой воде:
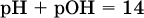
Это равенство справедливо и для водных растворов:
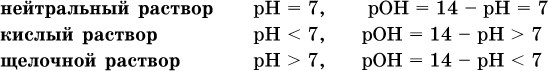
Практическая шкала рН отвечает интервалу 1—13 (разбавленные растворы кислот и оснований):
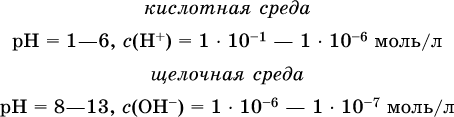
В практически нейтральной среде с рН = 6–7 и рН = 7–8 концентрация Н+ и ОН- очень мала (1 10-6 – 1 • 10-7 моль/л) и почти равна концентрации этих ионов в чистой воде. Такие растворы кислот и оснований считаются предельно разбавленными (содержат очень мало вещества).
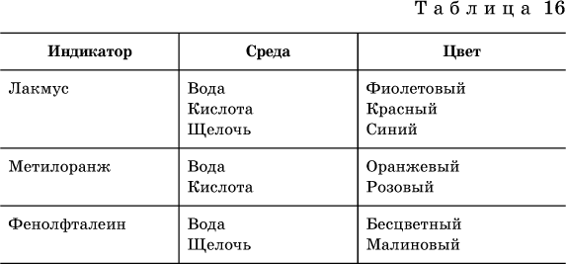
Для практического установления типа среды водных растворов служат индикаторы – вещества, которые окрашивают в характерный цвет нейтральные, кислые и/или щелочные растворы.
Распространенные в лаборатории индикаторы – это лакмус, метилоранж и фенолфталеин.
Метилоранж (индикатор на кислотную среду) становится розовым в сильнокислом растворе (табл. 16), фенолфталеин (индикатор на щелочную среду) – малиновым в сильнощелочном растворе, а лакмус используется во всех средах.
Назад: 13.2. Электролитическая диссоциация
Дальше: 13.4. Реакции ионного обмена

