Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 7.4. Неметаллы VA-группы
Дальше: 8. Теория строения, многообразие, классификация и номенклатура органических соединений. Типы химических реакций
7.5. Неметаллы IVA-группы
7.5.1. Углерод в свободном виде
Углерод – элемент 2-го периода и IVA-группы Периодической системы, порядковый номер 6. Химия углерода – это в основном химия органических соединений; неорганических производных углерода не так много. Электронная формула атома [3He]2s22p2, характерные степени окисления 0, -IV, +II и +IV, состояние CIV считается устойчивым.
Шкала степеней окисления углерода:
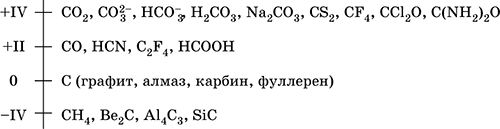
Углерод имеет среднюю для неметаллов электроотрицательность (2,50), проявляет неметаллические (кислотные) свойства. Неорганические углеродсодержащие вещества – оксиды, угольная кислота и ее соли, бинарные соединения; органические вещества – практически неограниченное число соединений с водородом (углеводороды) и их производных, содержащих различные по длине цепи и циклы атомов углерода.
В природе – одиннадцатый по химической распространенности элемент (четвертый среди неметаллов). Встречается в самородном состоянии (алмаз, графит) и в виде соединений. Жизненно важный элемент для всех организмов.
Аллотропные формы углерода С. В свободном виде углерод существует в виде четырех аллотропных модификаций: графит, алмаз, карбин и фуллерен.
Г р а ф и т – устойчивая аллотропная форма существования элемента. Серо-черный, с металлическим блеском, жирный на ощупь, мягкий, обладает электропроводимостью. Кристаллическая решетка состоит из слоев правильных шестиугольных колец, конденсированных по всем сторонам за счет оя-связей (вр2-гибридизация). Реагирует с водяным паром, кислотами-окислителями. Типичный восстановитель при сплавлении, реагирует с кислородом, оксидами металлов и солями. Восстанавливается водородом и металлами.
Для графита характерно образование множества карбидов – солеобразных (СаС2, Al4С3), ковалентных (карборунд SiC), металлоподобных (имеющих нестехиометрический состав, например цементит Fe3C). Солеобразные карбиды полностью гидролизуются в воде.
Применяется как конструкционный материал, основа угольных электродов, замедлитель нейтронов в ядерных реакторах, кокс – восстановитель в металлургии и химической технологии, сажа – наполнитель резины.
Алмаз содержит в узлах кристаллической решетки атомы С с тетраэдрическим окружением (sр3-гибридизация, р 3,52 г/см3). Благородный камень, имеет наибольшую твердость среди природных веществ. Химическая активность ниже, чем у графита. Выше 1200 °C переходит в графит. В чистом состоянии алмазы – прозрачные бесцветные кристаллы с сильным преломляющим эффектом. После обработки природных алмазов (огранка, шлифовка) получают ювелирные драгоценные камни — бриллианты. Менее чистые алмазы обычно окрашенные и мутные, например серо-голубой и черный (карбонадо).
В промышленности из графита при 2000 °C под очень высоким давлением получают мелкие кристаллы искусственных алмазов. Применяются они для изготовления режущих инструментов и точных измерительных приборов.
Карбин состоит из линейных макромолекул (С2)n со строением —C≡C– или =C=C= (sр-гибридизация, ρ 3,27 г/см3). Химически менее активен, чем графит. При 2300 °C переходит в графит. Прозрачен и бесцветен, полупроводник. Широкого применения не имеет, очень редко встречается в природе.
Фуллерен состоит из молекул C60 или C70 (полые сферы; sр2-гибридизация, ρ 1,7 г/см3, температура плавления 500–600 °C для С60), термически устойчив до 900– 1000 °C.
Темноокрашенный порошок, растворим в гексане (темно-красный раствор для С60 темно-оранжевый для С70), полупроводник. Химические свойства изучены мало. Получают фуллерен, испаряя графит в атмосфере гелия при пониженном давлении. Обнаружен в природе. Возможное использование в будущем – основа сверхпроводящих материалов.
Ниже рассматриваются свойства графита как самой распространенной и химически активной формы углерода.
Уравнения важнейших реакций:
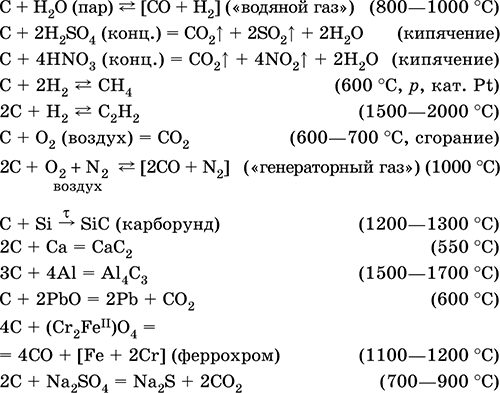
Получение: искусственные формы графита — кокс и сажа образуются при пиролизе каменного угля и углеводородов.
7.5.2. Оксиды углерода
Монооксид углерода СО. Несолеобразующий оксид. Бесцветный газ, без запаха, легче воздуха. Молекула слабополярна, содержит ковалентную тройную σππ-связь [:C≡O;], изоэлектронна молекуле N2. Термически устойчив. Малорастворим в воде и не реагирует с ней. Химически пассивен в обычных условиях, не реагирует с кислотами и щелочами. Сильный восстановитель при высокой температуре и при наличии катализаторов. Вступает в реакции присоединения с кислородом и пероксидом натрия. С переходными металлами образует комплексные соединения без внешней сферы (карбонилы). Количественно реагирует с I2O5.
Качественная реакция – помутнение раствора хлорида палладия(II).
Применяется как реагент в органическом синтезе, промышленно важный восстановитель металлов из их руд.
Чрезвычайно ядовит, загрязняет атмосферу городов (продукт неполного сгорания моторного топлива). По тому же механизму, что и кислород, СО присоединяется к атому железа в гемоглобине крови, причем связывается более прочно и тем самым блокирует перенос кислорода в организме, вызывая сильное отравление и остановку дыхания; отсюда тривиальное название СО — угарный газ.
Уравнения важнейших реакций:
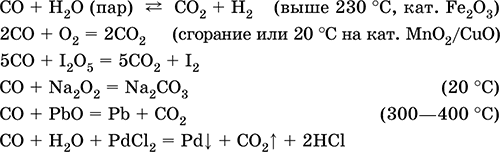
Получение в промышленности: сжигание кокса (см.) при недостатке кислорода, восстановление раскаленным коксом углекислого газа и водяного пара:

Диоксид углерода СO2. Кислотный оксид. Техническое название — углекислый газ. Бесцветный газ, без запаха, в 1,5 раза тяжелее воздуха (можно «переливать» из сосуда в сосуд). Молекула неполярна, имеет линейное строение [С(O)2] (sр-гибридизация), содержит ковалентные σπ-связи С=O. Термически устойчив до температуры красного каления. При сжатии (давление = 50 атм) и охлаждении легко переходит в жидкое и твердое («сухой лед») состояния.
Твердый СO2 возгоняется уже при низких температурах. Мало растворим в воде (O,88 л/1 л Н2O при 20 °C); образует моногидрат, который медленно изомеризуется (на 0,4 %) в угольную кислоту. Реагирует со щелочами. Восстанавливается магнием и кальцием. Из воздуха удаляется при контакте с пероксидом натрия (одновременно регенерируется кислород).
Простейшая качественная реакция – угасание горящей древесной лучинки в атмосфере СO2.
Применяется в многотоннажных производствах соды, сахара и карбамида, в пищевой промышленности для газирования безалкогольных напитков и как хладагент.
Содержится в воздухе (0,03 % по объему), воде минеральных источников. Не поддерживает горение и дыхание. Ассимилируется зелеными растениями при фотосинтезе (с помощью хлорофилла и под воздействием солнечных лучей). Ядовит при содержании в воздухе свыше 15 % по объему.
Уравнения важнейших реакций:

Получение в промышленности – при полном сгорании кокса (см.) или при обжиге известняка:
СаСO3 = СаО + СO2 (900—1200 °C)
в лаборатории – при обработке карбонатов (например, кусочков мрамора СаСO3) сильными кислотами:
СаСO3(т) + H2SO4 = CaSO4↓ + Н2O + CO2↑
7.5.3. Карбонаты
Карбонат натрия Na2CO3. Оксосоль. Техническое название кальцинированная сода. Белый, при нагревании плавится и разлагается. Чувствителен к влаге и углекислому газу в воздухе. Образует декагидрат (кристаллическая сода). Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Разлагается сильными кислотами. Восстанавливается коксом. Вступает в реакции ионного обмена.
Качественная реакция на ион СО32- – образование белого осадка карбоната бария, разлагаемого сильными кислотами (НCl, HNO3) с выделением углекислого газа.
Применяется для синтеза соединений натрия, устранения «постоянной» жесткости пресной воды, в производстве стекла, мыла и других моющих средств, целлюлозы, минеральных красок, эмалей. В природе содержится в грунтовых рассолах, рапе соляных озер.
Уравнения важнейших реакций:
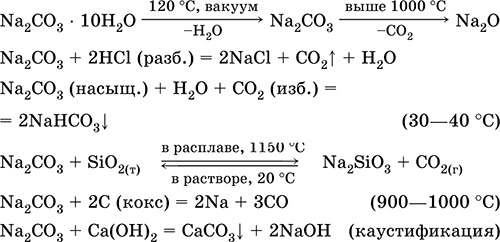
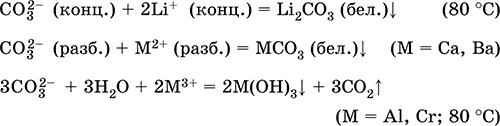
Получение в промышленности (способ Сольве, 1861–1863):
а) через насыщенный раствор NaCl пропускают смесь NH3 и СO2:
NaCl + NH3 + Н2O + СO2 = NH4Cl + NaHCO3↓
(в этих условиях питьевая сода малорастворима);
б) осадок NaHCO3 подвергают обезвоживанию (кальцинированию):
2NaHCO3 = Na2CO3 + Н2O + СO2
Карбонат калия К2СO3. Оксосоль. Техническое название поташ. Белый, гигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Чувствителен к влаге и углекислому газу в воздухе. Очень хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Разлагается сильными кислотами. Вступает в реакции ионного обмена.
Применяется в производстве оптического стекла, жидкого мыла, минеральных красок, многих соединений калия, как дегидратирующий агент.
Уравнения важнейших реакций:
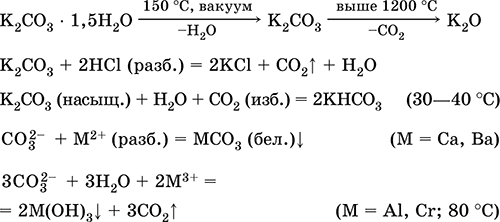
Получение в промышленности:
а) нагревание сульфата калия [природное сырье – минералы каинит KMg(SO4)Cl ЗН2O и шёнит K2Mg(SO4)2 • 6Н2O] с гашёной известью Са(ОН)2 в атмосфере СО (давление = 15 атм):
K2SO4 + Са(ОН)2 + 2СО = 2K(HCOO) + CaSO4
б) прокаливание формиата калия К(НСОО) на воздухе:
2K(HCOO) + O2 = К2СO3 + Н2O + СO2
Гидрокарбонат натрия NaHCO3. Кислая оксосоль. Техническое название питьевая сода. Белый рыхлый порошок. При слабом нагревании разлагается без плавления, во влажном состоянии начинает разлагаться при комнатной температуре. Умеренно растворим в воде, гидролизуется по аниону в небольшой степени. Разлагается кислотами, нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион НСОд – образование белого осадка карбоната бария при действии баритовой воды и разложение осадка сильными кислотами (НCl, HNO3) с выделением углекислого газа. Применяется в пищевой промышленности, как лекарственное средство.
Уравнения важнейших реакций:
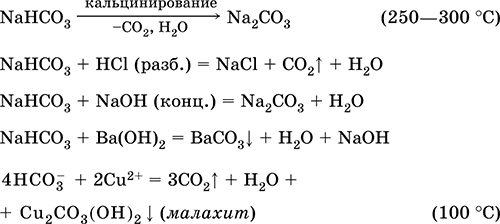
Получение: насыщение раствора Na2CO3 (см.) углекислым газом.
Карбонат кальция СаСO3. Оксосоль. Распространенное природное вещество, главная составная часть осадочной горной породы – известняка (его разновидности – мел, мрамор, известковый туф, мергель), чистый СаСO3 в природе – это минерал кальцит. Белый, при прокаливании разлагается, плавится под избыточным давлением СO2. Нерастворим в воде (= 0,0007 г/100 г Н2O).
Реагирует с кислотами, солями аммония в горячем растворе, коксом. Переводится в раствор действием избытка углекислого газа с образованием гидрокарбоната Са(НСO3)2 (существует только в растворе), который определяет «временную» жесткость пресной воды (вместе с солями магния и железа). Устранение жесткости (умягчение воды) проводится кипячением или нейтрализацией гашёной известью.
Применяется для производства СаО, СO2, цемента, стекла и минеральных удобрений [в том числе известковой селитры Ca(NO3)2 4Н2O], как наполнитель бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осажденного порошка – для изготовления школьных мелков, зубных порошков и паст, смесей для побелки помещений.
Уравнения важнейших реакций:
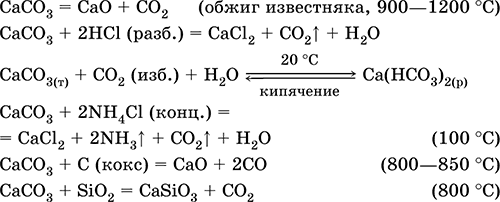
7.5.4. Кремний
Кремний – элемент 3-го периода и IVA-группы Периодической системы, порядковый номер 14. Электронная формула атома [10Ne]3s23p2. Характерная степень окисления в соединениях +IV.
Шкала степеней окисления кремния:
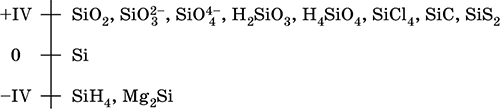
Электроотрицательность кремния невысока для неметаллов (2,25). Проявляет неметаллические (кислотные) свойства; образует оксиды, кремниевые кислоты, очень большое число солей – силикатов в виде цепей, лент и трехмерных сеток тетраэдров [SiO4], бинарные соединения. В настоящее время широко развивается химия органических соединений кремния со связями Si – С и кремнийорганических полимеров – силиконов и силиконовых каучуков со связями Si – Si, Si – О и Si – С.
Важнейший элемент неживой природы, второй по химической распространенности. Встречается только в связанном виде. Жизненно важный элемент для многих организмов.
Кремний Si. Простое вещество. Крупнокристаллический – темно-серый, с металлическим блеском, весьма твердый, очень хрупкий, непрозрачный, тугоплавкий, распространенный полупроводник. Кристаллическая решетка – атомная, связи Si – Si очень прочные. Аморфный – белый или желто-коричневый (с примесями, в основном Fe), химически более активен. Устойчив на воздухе (покрыт прочной оксидной пленкой), не реагирует с водой. Реагирует с HF (конц.), щелочами. Окисляется кислородом, хлором. Восстанавливается магнием. Спекается с графитом. Промышленно важным является сплав с железом – ферросилиций (12–90 % Si). Применяется как легирующая добавка в стали и сплавы цветных металлов, компонент полупроводниковых материалов для микроэлектроники, основа силиконов.
Уравнения важнейших реакций:
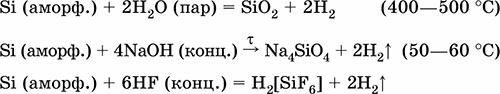

Получение в промышленности: восстановление SiCl4 или SiO2 при прокаливании:
SiCl4 + 2Zn = Si + 2ZnCl2
SiO2 + 2Mg = Si + 2MgO
(последняя реакция может быть осуществлена и в лаборатории, после обработки соляной кислотой остается аморфный кремний).
Диоксид кремния SiO2. Кислотный оксид. Белый порошок (кварцевый песок) и прозрачные кристаллы, природный продукт окрашен примесями (кремнезём) – в виде обычного песка и камня (кремень). Кристаллическая решетка атомная, каждый атом кремния окружен четырьмя атомами кислорода [Si(O)4], а каждый атом кислорода – двумя атомами кремния [O(Si)2]. Имеет несколько кристаллических модификаций (все минералы), важнейшие — кварц, тридимит и кристобалит, редко встречающиеся и искусственно полученные — китит, коэсит, стишовит, меланофлогит, волокнистый кремнезём. Тугоплавкий, при медленном охлаждении расплава образуется аморфная форма – кварцевое стекло (в природе минерал лешательеит). Наиболее химически активна аморфная форма.
Практически не реагирует с водой (из раствора осаждается гидрат SiO2 nН2O), распространенными кислотами. Кварцевое стекло разъедается в HF (конц.). Реагирует со щелочами в растворе (образует ортосиликаты) и при сплавлении (продукты — метасиликаты). Легко хлорируется в присутствии кокса. Восстанавливается коксом, магнием, железом (в доменном процессе).
Применяется как промышленное сырье в производстве кремния, обычного, термо– и химически стойкого стекла,
фарфора, керамики, абразивов и адсорбентов, наполнитель резины, смазок, клеев и красок, компонент строительных связующих растворов, в виде монокристаллов кварца – основа генераторов ультразвука и точного хода кварцевых часов. Разновидности кварца (горный хрусталь, розовый кварц, аметист, дымчатый кварц, халцедон, оникс и др.) – драгоценные, полудрагоценные или поделочные камни.
Уравнения важнейших реакций:

Полигидрат диоксида кремния SiO2 nH2O. Кремниевые кислоты с переменным содержанием SiO2 и Н2O. Белый, аморфный (стекловидный) полимер с цепочечным, ленточным, листовым, сетчатым и каркасным строением. При нагревании постепенно разлагается. Очень мало растворим в воде. Над осадком в растворе существует мономерная слабая ортокремниевая кислота H4SiO4 (тетраэдрическое строение, sр3-гибридизация), растворимость 0,00673 г/100 г Н2O при 20 °C. При стоянии раствора идет поликонденсация и медленно образуются вначале кремниевые кислоты H6Si2O7, H2Si2O5, H10Si2O9, затем гидрозоль [H2SiO3]n (золь метакремниевой кислоты) и, наконец, гидрогель SiO2 • nН2O (n < 2). При высушивании гидрогель переходит в силикагель SiO2 • nН2O (n < 1). Скорость гелеобразования максимальна в слабокислотной среде.
Переводится в раствор действием концентрированных щелочей. По остальным химическим свойствам подобен SiO2. В природе – минералы опал и халцедон (агат, яшма). Мономерная метакремниевая кислота H2SiO3 не получена.
Уравнения важнейших реакций:
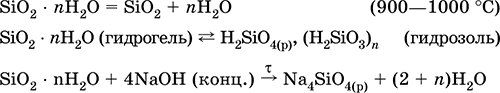
Получение: вытеснение сильной кислотой из раствора силиката, например:
K2SiO3 + 2НCl + (n – 1) Н2O = 2КCl + SiO2 nН2O↓
Метасиликат натрия Na2SiO3. Оксосоль. Белый, при нагревании плавится без разложения. Растворяется в холодной воде (сильный гидролиз по аниону). Концентрированный раствор – коллоидный («жидкое стекло», содержит гидрозоль SiO2 nН2O). Разлагается в горячей воде, реагирует с кислотами, щелочами, углекислым газом.
Применяется как компонент шихты в производстве стекла, специальных цементов и бетонов, входит в состав силикатных красок и клея, холодных глазурей, алюмосиликатных катализаторов, при изготовлении бумаги и картона, силикагеля, синтетических цеолитов. Уравнения важнейших реакций:
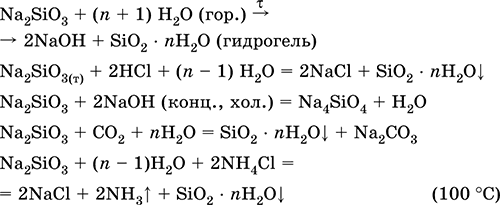
Получение: сплавление соды с песком
Na2SiO3 + SiO2 = СO2 + Na2SiO3 (1150 °C)
Силикаты. Кремний в степени окисления +IV находится, помимо SiO2, в весьма многочисленных и часто очень сложных по составу и строению силикат-ионах (так, кроме жетасиликат-иона SiO32- и ортосиликат-иона SiO44- известны ионы Si2O76-, Si3O96-, Si2O104- и др.). Для простоты записи все силикаты изображают как содержащие ион SiO32-.
Насыщенный раствор силикатов натрия и калия (вязкое «жидкое стекло») используется как силикатный клей.
Силикаты натрия и кальция входят в состав стекла; его получают сплавлением кварца SiO2, известняка СаСO3 и соды Na2CO3:
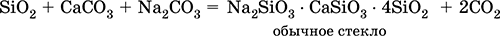
Часто состав стекла выражают через оксиды, например, обычное стекло Na2O СаО • 6SiO2.
Среди силикатных минералов отметим глины (алюмосиликаты), очень чистая глина — каолин Al2O3 2SiO2 • 2Н2O используется для изготовления фарфора.
Силикаты и алюмосиликаты применяют в промышленности при производстве керамики, цемента, бетона и других строительных материалов.
Тетрахлорид кремния SiCl4. Бинарное соединение. Бесцветная жидкость, обладает широким интервалом жидкого состояния. Молекула имеет тетраэдрическое строение (sр3-гибридизация). Термически устойчив. «Дымит» во влажном воздухе. Полностью гидролизуется водой. Разлагается щелочами. Восстанавливается водородом, натрием, цинком. Хлорирует оксид алюминия.
Применяется в производстве особо чистого кремния для полупроводниковой техники.
Уравнения важнейших реакций:
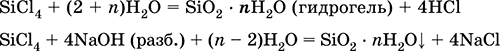
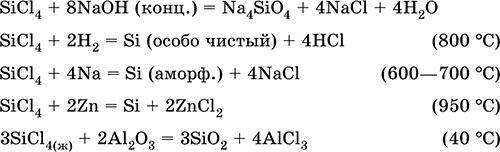
Получение в промышленности – хлорирование кремния или кварцевого песка SiO2.
Примеры заданий части А
1. Хлор можно собрать
1) в пробирку отверстием вниз
2) в пробирку отверстием вверх
3) над раствором хлорида кальция
4) над водой
2. Пропускают хлор через горячий раствор едкого кали и получают набор продуктов
1) КCl, O2
2) КCl, КClO
3) КCl, Н2
4) КClO3, КCl
3. Возможно протекание реакции в растворе между веществами
1) КBr + I2 →…
2) КBr + Cl2 →…
3) КCl + I2 →…
4) КCl + Br2 →…
4. Окислительная способность в ряду O2 – O3 – О0
1) возрастает
2) убывает
3) не изменяется
4) не знаю
5. При действии концентрированным раствором щелочи на серу образуется набор солей
1) сульфат, сульфид
2) сульфат, сульфит
3) сероводород, серная кислота
4) сульфит, сульфид
6. Концентрированная серная кислота реагирует (по отдельности) с веществами набора
1) KHSO4, K2SO4
2) Fe, Cu(NO3)2
3) Ag, SO2
4) КНСO3, С (графит)
7. Азот образуется при прокаливании солей
1) NH4NO2
2) NH4HCO3
3) NH4NO3
4) (NH4)2Cr2O7
8. В уравнении реакции NH3 + O2 → NO +… коэффициент у формулы окислителя равен
1) 6
2) 5
3) 4
4) 3
9. Нельзя проводить осушку газа NH3 с помощью
1) СаО (тв.)
2) NaOH (тв.)
3) H2SO4 (конц.)
4) Р2O5 (тв.)
10. Две соли разных кислот образуются при взаимодействии между щелочью и
1) диоксидом углерода
2) триоксидом серы
3) оксидом хлора (VII)
4) оксидом азота (IV)
11. Один газ образуется при прокаливании
1) Cu(NO3)2
2) Pb(NO3)2
3) AgNO3
4) KNO3
12. Ортофосфорную кислоту в промышленности получают по реакции
1) Са3(РO4)2 + H2SO4 (конц.) →…
2) К3РO4 + H2SO4 (разб.) →…
3) Р2O5 + Н2O →…
4) Na3PO4 + СаCl2 →…
13. Углекислый газ, растворенный в воде, реагирует (по отдельности) с веществами набора
1) К2СO3, К3РO4
2) KNO2, NH4Cl
3) K2SiO3, К2СO3
4) K2SO4, КОН
14. Реагенты для получения чистого гидрокарбоната калия – это набор
1) KNO3, Н2O, СO2
2) K2SO4, Ва(НСO3)2
3) К2СO3, Н2O
4) КОН, СаСO3
15. Цинк из концентрированного раствора карбоната калия вытесняет
1) водород
2) угарный газ
3) метан
4) углекислый газ
16. Влажную смесь газов SO2 + O2 + NH3 + С2Н2 пропустили через склянку с H2SO4 (конц.), затем – через склянку с гранулами NaOH. При этом на выходе собрали набор газов
1) NH3, С2Н2
2) SO2, O2
3) SO2, NH3
4) O2, С2Н2
17. Для обнаружения хлорид-иона подходит реактив
1) раствор крахмала
2) раствора нитрата серебра(I)
3) разбавленная серная кислота
4) концентрированный раствор щелочи
18. Для распознавания Na2CO3 и Na2SiO3 можно использовать раствор
1) азотной кислоты
2) индикатора
3) хлорида бария
4) гидроксида натрия
19—22. Бесцветный раствор соли
19. иодид алюминия
20. гидросульфат калия
21. хлорид бария
22. фторид натрия окрасится метилоранжем в цвет
1) оранжевый
2) желтый
3) синий
4) розовый
Назад: 7.4. Неметаллы VA-группы
Дальше: 8. Теория строения, многообразие, классификация и номенклатура органических соединений. Типы химических реакций

