Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 5.4. Жёсткость воды
Дальше: 6. Переходные металлы 4-го периода. Свойства, способы получения. Общие свойства металлов
5.5. Алюминий
Алюминий – элемент 3-го периода и IIIA-группы Периодической системы, порядковый номер 13. Электронная формула атома [10Ne]3s23p1, степени окисления + III и 0.
По электроотрицательности (1,47) одинаков с бериллием, проявляет амфотерные (кислотные и основные) свойства. В соединениях может находиться в составе катионов и анионов.
В природе – четвертый по химической распространенности элемент (первый среди металлов), находится в химически связанном состоянии.
Алюминий Al. Серебристо-белый, блестящий, легкий и пластичный металл. На воздухе покрывается матовой защитной пленкой Al2O3, весьма устойчивой и защищающей металл от коррозии; пассивируется в воде и концентрированной HNO3 (образование той же оксидной пленки).
Реакционноспособный, сгорает на воздухе, при комнатной температуре реагирует с галогенами Cl2, Br2 и I2, при нагревании – с фтором, серой:
4Al(порошок) + 3O2(воздух) = 2Al2O3 (700 °C)
2Al(порошок) + ЗЕ2 = 2AlЕ3 (25 °C, Е = CI, Br)
2Al(порошок) + 3I2 = 2AlI3 (25 °C, кат. – капля Н2O)
2Al + 3F2 = 2AlF3 (600 °C)
2Al + 3S = Al2S3 (150–200 °C)
Алюминий восстанавливает другие металлы из их оксидов (промышленно важный метод — алюминотермия):
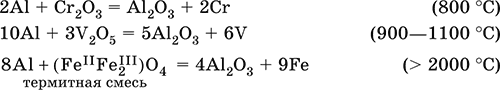
Амальгамированный алюминий, т. е. очищенный от оксидной пленки, энергично и с большим экзо-эффектом реагирует с водой:
2Al + 6Н2O = 2Al(ОН)3↓ + ЗН2↑ + 836 кДж
Алюминий – сильный (типичный) восстановитель, в ряду напряжений стоит значительно левее водорода; вытесняет водород из разбавленных кислот НCl и H2SO4:
2Al + 6Н+ = 2Al3+ + ЗН2↑
и, проявляя амфотерность, из концентрированного раствора щелочей (окислитель – вода):
2Al + 2NaOH + 6Н2O = 2Na[Al(OH)4] + ЗН2↑ (80 °C)
Реагирует со щелочами в расплаве (также демонстрируя амфотерные свойства):
2Al + 6NaOH(T) = 2NaAlO2 + ЗН2 + 2Na2O (450 °C)
Взаимодействует с разбавленной азотной кислотой:
Al + 4НNO3(разб.) = Al(NO3)3 + NO↑ + 2Н2O
и восстанавливает Nv до N-III в реакциях с очень разбавленной азотной кислотой и ее солями:
8Al + З0НNO3(оч. разб.) = 8Al(NO3)3 + 3NH4NO3 + 9Н2O
8Al + 18Н2O + 5КОН + 3KNO3 = 8К[Al(ОН)4] + 3NH3↑ (кипячение)
(движущей силой этих реакций служит промежуточное выделение атомарного водорода Н0, а во второй реакции – также и образование устойчивого гидроксокомплекса [Al(OH),]-).
Получение алюминия в промышленности – электролиз Al2O3 в расплаве криолита Na3[AlF6] при 950 °C:
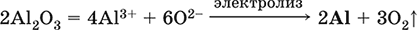
Применяется как реагент в алюминотермии для получения редких металлов и термитной сварке стальных конструкций. Алюминий – важнейший конструкционный материал, основа легких коррозионно-стойких сплавов (с магнием — дуралюмин, или дюраль, с медью — желтая алюминиевая бронза, из которой чеканят мелкую разменную монету). Чистый алюминий в больших количествах идет на изготовление посуды и электрических проводов.
Оксид алюминия Al2O3. Амфотерный оксид, кислотные и основные свойства равно выражены. Белый, имеет ионное строение (Al3+)2(O2-)3. Тугоплавкий, термически устойчивый. Аморфный порошок гигроскопичен и химически активен, кристаллический – очень тверд и химически пассивен. Не реагирует с водой, разбавленными кислотами и щелочами. Переводится в раствор концентрированными кислотами и щелочами, реагирует со щелочами и карбонатом натрия при сплавлении. Применяется как сырье в производстве алюминия, для изготовления огнеупорных, химически стойких и абразивных материалов, особо чистый Al2O3 – для изготовления рубиновых лазеров и синтетических драгоценных камней (рубины, сапфиры и др.), окрашенных примесями оксидов других металлов – Cr2O3 (красный цвет), Ti2O3 и Fe2O3 (голубой цвет).
Уравнения важнейших реакций:
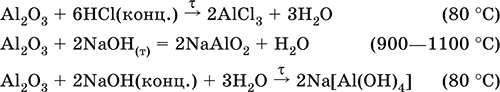
(эта реакция используется для «вскрытия» бокситов)
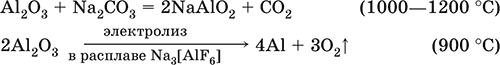
В природе входит в состав глины и бокситов, образует минерал корунд.
Гидроксид алюминия Al(ОН)3. Амфотерный гидроксид, кислотные и основные свойства равно выражены. Белый, аморфный (гелеобразный) или кристаллический. Связи Al – ОН преимущественно ковалентные. Разлагается при нагревании без плавления. Практически не растворяется в воде. Реагирует с кислотами, щелочами в растворе и при сплавлении. Не реагирует с NH3 Н2O, NH4Cl, СO2, SO2 и H2S. Метагидроксид АlO(ОН) химически менее активен, чем Al(ОН)3. Промежуточный продукт в производстве алюминия. Применяется для синтеза других соединений алюминия (в том числе криолита), органических красителей, как лекарственный препарат при повышенной кислотности желудочного сока.
Уравнения важнейших реакций:
• термическое разложение
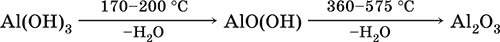
• основная и кислотная диссоциация в растворе
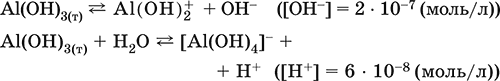
(реакции характеризуют очень малую растворимость в воде и амфотерность гидроксида, поставляющего в раствор одновременно ионы ОН и Н+ примерно в равной концентрации; гидроксид диссоциирует слабее, чем сама вода)
• амфотерные свойства
Al(ОН)3 + ЗНСlразб.) = AlCl3 + ЗН2O
Al(ОН)3 + NaOH(т) = NaAlO2 + 2Н2O (1000 °C)
Al(ОН)3 + NaOH(конц.) = Na[Al(OH)4](p)
Для получения осадка Al(ОН)3 щелочь обычно не используют из-за легкости перехода осадка в раствор (см. выше), а действуют на соли алюминия гидратом аммиака. При комнатной температуре образуется Al(ОН)3, а при кипячении – менее активный АlO(ОН):
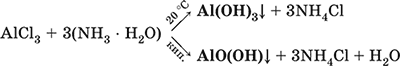
Удобный способ получения Al(ОН)3 – пропускание СO2 через раствор гидроксокомплекса:
[Al(ОН)4]- + СO2 = Al(ОН)3↓ + HCO3-
Тетрагидроксоалюминат(III) натрия Na[Al(OH)4]. Комплексная соль. С таким составом существует при комнатной температуре в концентрированном растворе NaOH. Для твердого состояния состав условный, так как при кристаллизации из раствора он усложняется (выделены Na4[Al(OH)7], Na4[Al4O3(OH)10] и др.). При прокаливании твердые соли разлагаются до диоксоалюмината(III) натрия NaAlO2, при разбавлении их растворов – до Al(ОН)3. По-разному реагируют с сильными и слабыми кислотами, с хлоридом алюминия и карбонатом аммония.
Уравнения важнейших реакций:
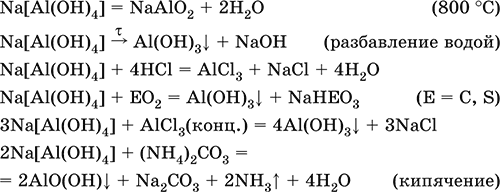
Получение: взаимодействие Al(ОН)3 и солей алюминия с NaOH в концентрированном растворе:
Al(OH)3 + NaOH(конц.) = Na[Al(OH)4]
AlCl3 + 4NaOH(конц.) = Na[Al(OH)4] + 3NaCl
Образуется из оксида алюминия (см.) как промежуточный продукт при промышленном «вскрытии» бокситов.
Примеры заданий части А
1. Среди металлов главной подгруппы II группы наиболее сильным восстановителем является
1) барий
2) кальций
3) стронций
4) магний
2. При сжигании магния на воздухе образуются
1) Mg(OH)2
2) MgO
3) Mg(NO3)2
4) Mg3N2
3. Алюминий будет выделять водород из реактива
1) HNO3 (разб.)
2) NaHSO4 (разб.)
3) H2SO4 (конц.)
4) NaOH (конц.)
4. Реакция замещения протекает в растворе между алюминием и
1) Na2SO4
2) BeSO4
3) NiSO4
4) MgSO4
5. Из раствора гидрокарбоната бария выпадает осадок при добавлении реактивов
1) ВаО
2) СO2
3) Ва(ОН)2
4) H2SO4
6. Калий можно получить электролизом на угольных электродах из
1) раствора КCl
2) раствора KNO3
3) расплава КCl
4) расплава смеси КCl и MgCl2
7—8. Если внести каплю раствора
7. поваренной соли
8. хлорида калия
в бесцветное пламя газовой горелки, оно станет
1) красным
2) желтым
3) зеленым
4) фиолетовым
9. Устранение временной жёсткости воды проводится по реакции
1) Са(НСO3)2 + Na3PO4 →…
2) Са(НСO3)2 + Са(ОН)2 →…
3) CaSO4 + Na2CO3 →…
4) СаCl2 + NaHCO3 →…
Назад: 5.4. Жёсткость воды
Дальше: 6. Переходные металлы 4-го периода. Свойства, способы получения. Общие свойства металлов

